
為做好醫療器械注冊人制度下注冊質量管理體系核查工作,提高醫療器械注冊質量管理體系核查工作質量,國家藥監局于2022年10月發布施行新修訂《醫療器械注冊質量管理體系核查指南》(以下簡稱《指南》)。《指南》共有核查項目73項,其中與設計開發相關的核查19項(其中標注*關鍵項目2個),占比26%。可以說,做好設計開發核查是確保注冊質量管理體系核查工作質量的關鍵之一。
《指南》施行已9個月,筆者認為,做好“設計開發文檔”(即設計開發核查項目中標注*關鍵項目之一)核查工作,需要做到三個“心中有數”和三個“準確把握”。

做到三個“心中有數”
對“設計開發文檔”實施注冊質量管理體系核查工作,應當做到三個“心中有數”。

一是對設計開發文檔的覆蓋范圍心中有數。《醫療器械 質量管理體系 用于法規的要求》第7.3.10條規定,組織應為每個醫療器械類型或醫療器械族保留設計和開發文檔;該文檔應包括或引用證實符合設計開發要求所形成的記錄以及設計開發更改的記錄,還應包含涉及和開發更改的記錄。
二是對設計開發文檔的合規要點心中有數。設計開發文檔至少應符合以下要求:保留了每個醫療器械類型或醫療器械族設計開發文檔;設計開發文檔均源于設計開發策劃、輸入、輸出、評審、驗證、確認、轉換、變更的相關文件,且包含設計開發過程中建立的記錄;歷次設計開發最終輸出過程及其相關活動可追溯。
三是對設計開發文檔的佐證材料清單(內容要素)心中有數。組織提供的佐證材料一般應包括:立項報告/設計開發任務書;設計開發項目計劃書/項目工作大綱;風險管理計劃及初始風險控制措施;設計開發輸入書/輸入清單及相關材料,以及其評審記錄;
設計開發輸出資料;其他階段的評審記錄(如有);設計開發驗證方案及報告;設計開發確認方案及報告;設計開發到生產轉換方案及報告;設計開發變更評審、驗證、確認記錄(如有);其他記錄,如工藝驗證和/或確認報告;設備驗證報告;典型產品選擇報告(如有);研制產品的采購、生產及驗證記錄;注冊檢驗產品采購、生產及驗證記錄;設備使用記錄;供方評價記錄及供方名錄;人員培訓及考核記錄等。
做到三個“準確把握”
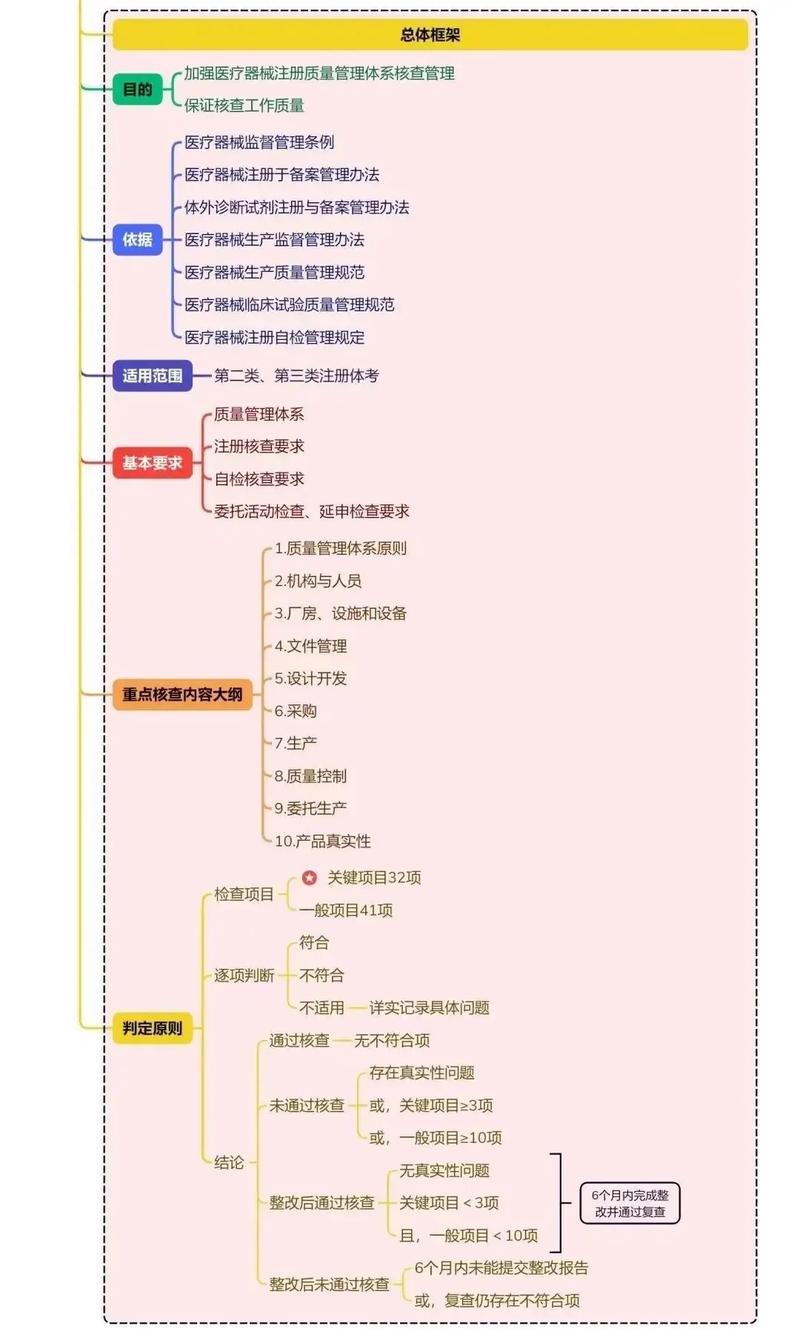
“設計開發文檔”核查內容涉及設計開發策劃、輸入、輸出、評審、驗證、確認、轉換、變更過程,監管人員應當做到三個“準確把握”。
一是準確把握現行法規規范對產品設計和開發過程的規制要求。《指南》是根據《醫療器械監督管理條例》和《醫療器械注冊與備案管理辦法》《體外診斷試劑注冊與備案管理辦法》《醫療器械生產監督管理辦法》及《醫療器械生產質量管理規范》等要求制定的,監管人員實施注冊質量管理體系現場檢查時,應當厘清《指南》與相關法律規范之間的對應關系,并將《指南》條款要求及該條款所對應的其他法規規范條款的要求一并考量。例如,《指南》第4.5.2(設計開發輸入)規定,設計和開發輸入一般應當包括法律法規、國家標準、行業標準、國內外指南文件、標準品或者參考物質信息(體外診斷試劑產品適用)、用戶需求、產品適用范圍、前代或者同類產品的技術指標、產品風險等。該條款對應的是《醫療器械生產質量管理規范》第三十條:“設計和開發輸入應當包括預期用途規定的功能、性能和安全要求、法規要求、風險管理控制措施和其他要求。”因此,設計開發輸入佐證材料內容須滿足上述兩個條款要求。再如,《指南》第4.5.3(設計開發輸出)規定,設計和開發輸出應當滿足輸入要求,以及符合用戶需求和產品設計需求,應當關注產品適用范圍、功能性、安全性、有效性、質量可控性。該條款對應的是《醫療器械生產質量管理規范》第三十一條:“設計和開發輸出應當滿足輸入要求,包括采購、生產和服務所需的相關信息、產品技術要求等。”因此,設計開發輸出佐證材料內容須滿足上述兩個條款要求。
二是準確把握核查內容涉及佐證材料的齊全性、符合性。《境內第三類醫療器械注冊質量管理體系核查工作程序》第五條規定,省、自治區、直轄市藥品監督管理部門按照醫療器械生產質量管理規范以及相關附錄、注冊質量管理體系核查指南的要求開展與產品研制、生產有關的質量管理體系核查。目前,開展醫療器械注冊質量管理體系核查時,須按照《指南》對現場檢查情況出具結論。醫療器械種類繁多,且對不同產品有不同的法規要求(如《體外診斷試劑注冊與備案管理辦法》《醫療器械生產質量管理規范附錄體外診斷試劑》《醫療器械生產質量管理規范體外診斷試劑現場檢查指導原則》只適用于體外診斷試劑類產品),監管人員只有充分厘清核查內容涉及的佐證材料清單/材料內容要素,并統一標準,才能確保現場檢查結論判定的準確性、公平和公正性。
三是準確把握發現問題的切入點,突出核查重點。注冊質量管理體系核查的現場檢查時間一般為1至3天(詳見《境內第三類醫療器械注冊質量管理體系核查工作程序》第八條),問題發現率與檢查員業務能力密切相關。監管人員需注重收集以往現場檢查中的常見問題,并歸類匯總,為現場檢查提供靶向性信息,以找準核查重點及發現問題的切入點,確保工作質量和效率。
聲明:此文版權歸原作者所有,文中圖片均已獲得版權方授權使用。若有來源錯誤或者侵犯您的合法權益,您可通過站內私信與我們取得聯系,我們將及時進行處理。
*請認真填寫需求信息,我們會在24小時內與您取得聯系。